 Certamente você já deve estar “careca” de saber que a prova do Enem é diferente, pois prioriza muito mais uma boa leitura do que aquela quantidade de conteúdo que torna (ou tornava) os vestibulares tradicionais tão maçantes. De fato, essa afirmação não deixa de ser verdadeira.
Certamente você já deve estar “careca” de saber que a prova do Enem é diferente, pois prioriza muito mais uma boa leitura do que aquela quantidade de conteúdo que torna (ou tornava) os vestibulares tradicionais tão maçantes. De fato, essa afirmação não deixa de ser verdadeira.
Entretanto, muito cuidado antes de abandonar seus estudos daquelas matérias chatas e que, aparentemente, nunca servirão no seu dia a dia! Depois de 2009, ano que o exame ganhou importância jamais vista em uma prova nacional, teve muita matéria que começou a cobrar dos candidatos conteúdos e conhecimentos bastante específicos! E essa exigência conteudista não deixa de ser natural. Afinal, para avaliar mais de 7 milhões de estudantes que estão saindo do ensino médio é necessário, evidentemente, um exame que contenha o conteúdo programático dessa fase do aprendizado escolar.
Um dos exemplos que mais simboliza essa cobrança é certamente a química orgânica, que aparece na prova de Ciências da Natureza e suas tecnologias. Antes de comentarmos mais a fundo, vamos ver uma questão dessa natureza que apareceu no último Enem (2012).
________________________
A própolis é um produto natural conhecido por suas propriedades anti-inflamatórias e cicatrizantes. Esse material contém mais de 200 compostos identificados até o momento. Dentre eles, alguns são de estrutura simples, como é o caso do C 6 H5 CO 2 CH2 CH3 , cuja estrutura está mostrada a seguir.
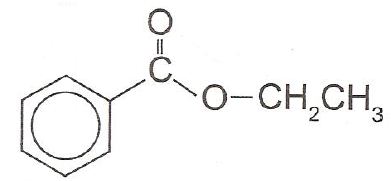
O ácido carboxílico e o álcool capazes de produzir o éster em apreço por meio da reação de esterificação são, respectivamente,
a) ácido benzoico e etanol.
b) ácido propanoico e hexanol.
c) ácido fenilacético e metanol.
d) ácido propiônico e cicloexanol.
e) ácido acético e álcool benzílico.
a) ácido benzoico e etanol.
b) ácido propanoico e hexanol.
c) ácido fenilacético e metanol.
d) ácido propiônico e cicloexanol.
e) ácido acético e álcool benzílico.
________________________
Fica claro que, utilizando apenas o raciocínio nessa questão, certamente você não passará nem perto da resposta correta! Vamos dar uma olhada na resolução do professor Jerferson dos Santos, formado em química pela Unicamp:
Alternativa A
Esta questão envolve um dos tipos de reação mais importantes na química orgânica. As reações de esterificação onde: ácido + álcool = éster + água. Observe que o éster acima pode ser dividido em duas partes formadoras, em seguida adiciona-se água e obtêm-se as duas moléculas procuradas.
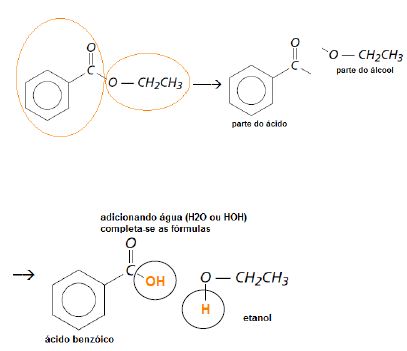
Ao analisar as alternativas a resposta fica mais simples, pois basta saber um dos dois compostos que se chega à letra A.
Comentário: Nesta questão é bom lembrarmos que o etanol é o álcool mais importante para nós brasileiros devido a sua utilização como combustível, nas bebidas e ainda os postos de gasolina trazem placas escritas “ETANOL”, o que também é uma grande dica de resolução.
Conteúdo envolvido: Química orgânica.
*Essa questão, resolvida e comentada pelo professor Jerferson, foi retirada das apostilas preparatórias para o Enem 2013.
Como podemos notar, pouco raciocínio é utilizado nessa questão. O candidato precisava de conhecimentos prévios para resolvê-la de forma segura. Dessa forma, segue algumas dicas de estudos de química orgânica para você se preparar para o Enem:
- Estude (decore!) o maior número de funções orgânicas. Diversas questões do exame exigem reconhecê-las!
- Conheça as principais reações orgânicas estudadas no ensino médio, como por exemplo, ácido + álcool = éster + água.
- Ao tentar reconhecer a reação química, diversas vezes os produtos e/ou reagentes envolvidos são substâncias que são bastante conhecidas. No exemplo acima, o Etanol. Portanto, conhecer a fórmula de diversas substâncias pode ajudar a encontrar a reação que se refere a questão.
De forma resumida, para se dar bem em química orgânica no Enem, é necessário muito estudo! E claro, ficar atento às nossas dicas para facilitar o reconhecimento das funções e reações orgânicas.
































.jpg)


